martes, 14 de mayo de 2013
 EL ATOMO
EL ATOMO
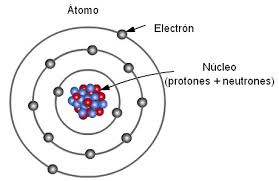
EL ATOMO ES LA PARTE MAS PEQUEÑA DE LA MATERIA .El átomo es un constituyente materia ordinaria, con propiedades químicas bien definidas, que mantiene su identidad. Cada elemento químico está formado por átomos del mismo tipo (con la misma estructura electrónica básica), y que no es posible dividir mediante procesos químicos. Está compuesto por un núcleo atómico, en el que se concentra casi toda su masa, rodeado de una nube de electrones. El núcleo está formado por protones, con carga positiva, y neutrones, eléctricamente neutros.nota 1 Los electrones, cargados negativamente, permanecen ligados a este mediante la fuerza electromagnética.

ISOTOPOS
Se denominan isótopos (del griego: ἴσος isos 'igual, mismo'; τόπος tópos 'lugar') a los átomosde un mismo elemento, cuyos núcleos tienen una cantidad diferente de neutrones, y por lo tanto, difieren en masa atómica. La mayoría de los elementos químicos tienen más de un isótopo. Solamente 21 elementos (ejemplos: berilio, sodio) poseen un solo isótopo natural; en contraste, el estaño es el elemento con más isótopos estables.
Otros elementos tienen isótopos naturales, pero inestables, como el uranio, cuyos isótopos están constantemente degradándose, lo que los hace radiactivos. Los isótopos inestables son útiles para estimar la edad de variedad de muestras naturales, como rocas y materia orgánica. Esto es posible, siempre y cuando, se conozca el ritmo promedio de desintegración de determinado isótopo, en relación a los que ya han decaído. Gracias a este método de datación, se conoce la edad de la tierra. Los rayos cósmicos hacen inestables a isótopos estables de Carbono que posteriormente se adhieren a material biológico, permitiendo así estimar la edad aproximada de huesos, telas, maderas, cabello, etc. Se obtiene la edad de la muestra, no la del propio isótopo, ya que se tienen en cuenta también los isótopos que se han desintegrado en la misma muestra. Se sabe el número de isótopos desintegrados con bastante precisión, ya que no pudieron haber sido parte del sistema biológico a menos que hubieran sido aún estables cuando fueron raros.
Isótopos Naturales. Los isótopos naturales son los que se encuentran en la naturaleza de manera natural, por ejemplo el hidrógeno tiene tres isótopos naturales, el protio que no tiene neutrones, el deuterio con un neutrón, y el tritio que contiene dos neutrones, el tritio es muy usado en trabajos de tipo nuclear; es el elemento esencial de la bomba de hidrógeno.
Otro elemento que contiene isótopos muy importantes es el carbono, que son: el carbono 12, que es la base referencial del peso atómico de cualquier elemento, el carbono 13 que es el único carbono con propiedades magnéticas y el carbono 14 radioactivo, muy importante ya que su tiempo de vida media es de 5730 años y se usa mucho en arqueología para determinar la edad de los fósiles orgánicos.
Isótopos Artificiales. Los isótopos artificiales se producen en laboratorios nucleares por bombardeo de partículas subatómicas; estos isótopos suelen tener una vida corta, principalmente por la inestabilidad y radioactividad que presentan; uno de estos es el Cesio cuyos isótopos artificiales se usan en plantas nucleares de generación eléctrica; otro muy usado es el Iridio 192 que se usa para comprobar la hermeticidad de las soldaduras de tubos, sobre todo en tubos de transporte de crudo pesado y combustibles. Alguno isótopos del Uranio también se usan para labores de tipo nuclear como generación eléctrica o en bombas atómicas basadas en la fisión nuclear.
ELECTRONES
El neutrón es una partícula subatómica, un nucleón, sin carga neta, presente en elnúcleo atómico de prácticamente todos los átomos, excepto el protio. Aunque se dice que el neutrón no tiene carga, en realidad está compuesto por tres partículas fundamentales cargadas llamadas quarks, cuyas cargas sumadas son cero. Por tanto, el neutrón es un barión neutro compuesto por dos quarks de tipo abajo, y un quark de tipo arriba.
Fuera del núcleo atómico, los neutrones son inestables, teniendo una vida media de 15 minutos (885,7 ± 0,8 s);2 cada neutrón libre se descompone en un electrón, unantineutrino y un protón. Su masa es muy similar a la del protón, aunque ligeramente mayor.
El neutrón es necesario para la estabilidad de casi todos los núcleos atómicos, a excepción del isótopo hidrógeno-1. La interacción nuclear fuerte es responsable de mantenerlos estables en los núcleos atómicos
PROTON
En física, el protón (del griego πρῶτον, prōton ['primero']) es una partícula subatómicacon una carga eléctrica elemental positiva 1 (1,6 × 10-19 C). igual en valor absoluto y de signo contrario a la del electrón, y una masa 1.836 veces superior a la de un electrón. Experimentalmente, se observa el protón como estable, con un límite inferior en su vida media de unos 1035 años, aunque algunas teorías predicen que el protón puede desintegrarse en otras partículas.
El protón y el neutrón, en conjunto, se conocen como nucleones, ya que conforman el núcleo de los átomos. En un átomo, el número de protones en el núcleo determina las propiedades químicas del átomo y qué elemento químico es. El núcleo del isótopo más común del átomo de hidrógeno (también el átomo estable más simple posible) está formado por un único protón. Al tener igual carga, los protones se repelen entre sí. Sin embargo, pueden estar agrupados por la acción de la fuerza nuclear fuerte, que a ciertas distancias es superior a la repulsión de la fuerza electromagnética. No obstante, cuando el átomo es grande (como los átomos de Uranio), la repulsión electromagnética puede desintegrarlo progresivamente.

Dmitri Mendeléiev
Dmitri Ivánovich Mendeléiev
Químico ruso
Nació el 8 de febrero 1834 en Tobolsk (Siberia).
Cursó estudios de Química en la Universidad de San Petersburgo y en 1859 en la Universidad de Heidelberg, donde conoció al químico italiano Stanislao Cannizzaro. Regresó a San Petersburgo y trabajó comoprofesor de química en el Instituto Técnico en 1863 y profesor de química general en la Universidad de San Petersburgo en 1866.
Escribió los dos volúmenes de Principios de química (1868-1870). Intentó clasificar los elementos según sus propiedades químicas. En el año 1869 publicó la primera versión de la tabla periódica. En 1871 publicó una versión corregida. También realizó investigaciones en el estudio de la teoría química de la disolución, la expansión térmica de los líquidos y la naturaleza del petróleo.
En el año 1887 comenzó un viaje en globo en solitario para realizar un estudio sobre un eclipse solar.
En 1893 fue nombrado director del departamento de Pesas y Medidas de San Petersburgo.
Dmitri Mendeléiev falleció el 2 de febrero de 1907 en San Petersburgo.

Suscribirse a:
Comentarios (Atom)

